Как определить кол во протонов. Как найти нейтроны
Примеры:
Водород Ar = 1,001; 1 нуклон
Углерод Ar = 12,011; 12 нуклонов.
Нуклиды, изотопы, массовое число
Большинство элементов, содержащихся в природе, состоит из нескольких видов атомов, отличающихся значениями относительной атомной массы.
Пример. Хлор в природе встречается как смесь двух видов атомов, один из которых содержит 18, а другой – 20 нейтронов в ядре.
Каждый вид атомов (вид ядер) называется нуклидом . Нуклид – это вид атомов и ядер, отвечающий определенным числам протонов и нейтронов.
Нуклиды, принадлежащие одному элементу и однозначно определяемые числом протонов, но различающиеся по числу нейтронов, называются изотопными нуклидами , или просто изотопами.
Изотопы элемента – это нуклиды, обладающие равным зарядом ядра (числом протонов). Изотопы элемента различаются только числом нейтронов и, следовательно, общим числом нуклонов.
Пример. Ядра двух природных изотопов хлора содержат по 17 протонов, но 18 и 20 нейтронов, т.е. 35 и 37 нуклонов соответственно.
Для нуклидов точные значения относительных атомных масс всегда близки к целочисленным значениям, поэтому массы нуклидов можно сравнивать по этим значениям, называемым массовыми числами .
Массовое число нуклида равно числу содержащихся в нем нуклонов (сумме протонов и нейтронов).
Для обозначения конкретного нуклида применяется специальная символика. Слева от символа химического элемента верхним индексом указывается массовое число, а нижним индексом – заряд ядра (порядковый номер элемента). Например, изотоп хлора-18 записывается как .
Таким образом:
Массовое число = Число нуклонов в ядре.
Порядковый номер = Число протонов в ядре или число электронов в оболочке атома.
Разность между массовым числом и порядковым номером = Число нейтронов в ядре.
Строение электронной оболочки атома. Энергетические уровни
Строение электронной оболочки атома определяется различным запасом энергии E отдельных электронов в атоме. В соответствии с моделью атома Бора электроны могут занимать в атоме положения, которым отвечают точно определенные (квантованные) энергетические состояния.
Число электронов, которые могут находиться на отдельном энергетическом уровне, определяется формулой 2n² , где n – номер уровня, который обозначается арабскими цифрами 1-7; для обозначения энергетических уровней используются также буквы от K до Q. Максимальное заполнение первых четырех энергетических уровней в соответствии с формулой 2n² составляет: для первого уровня К – 2 электрона, для второго L – 8, для третьего M – 18 и для четвертого уровня N – 32 электрона.
КВАНТОВО - МЕХАНИЧЕСКОЕ ОБЪЯСНЕНИЕ СТРОЕНИЯ АТОМА
Орбитальная модель атома
Современные квантово-механические представления о строении электронной оболочки атома исходят из того, что движение электрона в атоме нельзя описать определенной траекторией. Можно рассматривать лишь некоторый объем пространства, в котором находится электрон. Поскольку электрон обладает одновременно свойствами частицы и волны, то подходом к объяснению строения электронной оболочки может быть как корпускулярная теория, так и волновая теория; обе они приводят к одинаковому наглядному представлению, сформулированному как орбитальная модель атома .
1. Обоснование орбитальной модели атома, исходящее из корпускулярного характера электрона , состоит в следующем. Как следует из рис. 2 , вероятность пребывания электрона в атомном ядре равна нулю, она незначительна вблизи ядра, но быстро возрастает при удалении от ядра. На некотором расстоянии вероятность достигает максимума, а затем медленно уменьшается, ассимптотически приближаясь к нулю на расстоянии, стремящемся к бесконечности. Таким образом, невозможно ограничить то пространство, в котором может находиться электрон, т.е. нельзя (без дополнительных условий) указать размеры атома. Исходя из корпускулярного характера электрона можно говорить о 90 %-ой вероятности его пребывания в ограниченном объеме пространства, которое называется атомная орбиталь .
2. Обоснование орбитальной модели атома, исходящее из волнового характера электрона , состоит в следующем. Электрон заполняет пространство вокруг атомного ядра в форме стоячей волны, которую наглядно можно представить как электронное облако. Плотность электронного облака, понимаемого как облако электрического заряда электрона − электронная плотность – окажется различной и зависящей от расстояния ядро-электрон (рис.1 ). При ограничении электронной плотности до значения ~ 90 % получается та же орбитальная модель атома.
Атомная орбиталь – это геометрический образ, отвечающий объему пространства вокруг атомного ядра, который соответствует 90 %-ой вероятности нахождения в этом объеме электрона (как частицы) и одновременно 90 %-ой плотности заряда электрона (как волны).
Модель атомной орбитали (электронного облака) очень удобна для наглядного описания распределения электронной плотности в пространстве. При этом s-орбиталь имеет сферическую форму, р-орбиталь – форму гантели, d-орбиталь – четырехлепесткового цветка или удвоенной гантели, f-орбиталь – еще более сложную форму (рис. 3 ).
Если в атомной орбитали находится только один электрон (как в атоме водорода), то говорят об однократно занятой или полузаполненной, полузаселенной атомной орбитали. Если же в атомной орбитали находятся два электрона (как в атоме гелия), то говорят о двукратно занятой или полностью заполненной, полностью заселенной атомной орбитали. Полузаселенные АО играют важнейшую роль при формировании химических связей.
В соответствии с квантово-механическим описанием состояния электрона в атоме каждый электрон является индивидуальной частицей. Такие его свойства, как масса и заряд не выявляют различий между электронами, особенно между теми электронами, которые находятся на одной атомной орбитали (как в атоме гелия). Собственной характеристикой каждого электрона в атоме является спин .
Два электрона, находящиеся в одной атомной орбитали, различаются по спину .
Спин – квантово-механическое свойство электрона, которое невозможно точно объяснить с помощью традиционных представлений на основе механического поведения макрочастиц. Без учета волновых свойств электрона спин можно интерпретировать путем сравнения электрона с шаром, вращающимся вокруг выбранной оси. Спин характеризует направление вращения и, следовательно, при двух возможных направлениях механического вращения должно существовать два разных спина электрона.
Спин – неотъемлемая характеристика электрона в атоме; два электрона на одной атомной орбитали обладают антипараллельными спинами.
Атомную орбиталь удобно изображать в виде квадрата, называемого квантовой ячейкой, а каждый электрон − вертикальной стрелкой, обозначающей один из двух возможных спинов электрона. Квантовая ячейка с одной стрелкой означает атомную орбиталь с одним электроном, т.е. полузаселенную орбиталь, с двумя стрелками − атомную орбиталь с двумя электронами, т.е. полностью заселенную орбиталь, без стрелок – вакантную орбиталь, т. е. без электронов.
2.2. Орбитали с s, p , d - и f -электронами
(атомные s, p , d - и f -орбитали)
Атомную орбиталь, имеющую шаровую симметрию (рис. 3 ), принято обозначать как s-орбиталь (s-АО) , а находящиеся в ней электроны – как s-электроны .
Радиус атомной s-орбитали возрастает при увеличении номера энергетического уровня; 1s-АО расположена внутри 2s-АО, последняя – внутри 3s-АО и т.д. с центром, отвечающим атомному ядру. В целом строение электронной оболочки атома в орбитальной модели представляется слоистым. Каждый энергетический уровень, содержащий электроны, геометрически рассматривается как электронный слой.
Для сокращенного обозначения электрона, занимающего атомную s-орбиталь, используется обозначение самой s-АО с верхним цифровым индексом, указывающим число электронов. Например, 1s − обозначение единственного электрона атома водорода.
Номер энергетического уровня отвечает главному квантовому числу, а вид орбитали − орбитальному квантовому числу .
2s Li=1s 2s , Be=1s 2s
Электронная формула в сочетании с энергетической диаграммой электронной оболочки атома (рис. 3 ) отражают его электронную конфигурацию.
Атомную орбиталь, имеющую вращательную (осевую) симметрию принято обозначать как p-орбиталь (p -АО) (рис. 3 ); находящиеся в ней электроны – это p -электроны.
Каждая атомная p-орбиталь может принять (при максимальном заполнении) два электрона, подобно любой другой АО. Эти электроны сообща занимают обе половины p -орбитали. На каждом атомном энергетическом уровне (кроме первого) имеется три атомных орбитали, которым отвечает максимальное заселение шестью электронами.
Все три p -АО одного энергетического уровня отличаются друг от друга пространственным расположением; их собственные оси, проходящие через обе половины орбитали и перпендикулярные ее узловой плоскости, образуют систему декартовых координат (обозначения собственных осей x, y, z). Поэтому на каждом энергетическом уровне имеется набор трех атомных p-орбиталей: p x -, p y - и p z -АО. Буквы x, y, z соответствуют магнитному квантовому числу , позволяющему судить о влиянии внешнего магнитного поля на электронную оболочку атома.
Атомные s-орбитали имеются на всех энергетических уровнях, атомные p -орбитали − на всех уровнях, кроме первого. На третьем и последующих энергетических уровнях к одной s-АО и трем p -АО присоединяется пять атомных орбиталей, получивших название d -орбиталей (рис. 4 ), а на четвертом и последующих уровнях − еще семь атомных орбиталей, называемых f -орбиталями .
2.3. Энергетические подуровни
многоэлектронного атома. принципы
построения электронной оболочки
Квантово-механические расчеты показывают, что в многоэлектронных атомах энергия электронов одного уровня не одинакова; электроны заполняют атомные орбитали разных видов и имеют разную энергию.
Энергетический уровень характеризуется главным квантовым числом n. Для всех известных элементов значения n изменяются от 1 до 7. Электроны в многоэлектронном атоме, находящемся в основном (невозбужденном) состоянии, занимают энергетические уровни от первого до седьмого.
Энергетический подуровень характеризуется орбитальным квантовым числом l. Для каждого уровня (n = const) квантовое число l принимает все целочисленные значения от 0 до (n-1), например, при n=3 значениями l будут 0, 1 и 2. Орбитальное квантовое число определяет геометрическую форму (симметрию) орбиталей s-, p-, d-, f -подуровня. Очевидно, что во всех случаях n>l ; при n=3 максимальное значение l равно 2.
Под запросом «Как найти нейтроны» понимается метод поиска числа нейтронов в атоме. Нейтрон — это тяжелая частица, которая не имеет электрического заряда и вместе с протоном составляет атомное ядро элемента. Число нейтронов в атоме определяется с помощью таблицы Менделеева.
Как найти нейтроны — ищем число нейтронов в атомах
- Берем таблицу Менделеева и находим нужный элемент.
- Как вы знаете, химические элементы расположены не случайным образом. Порядковый номер элемента соответствует числу протонов, находящихся в одном атоме элемента — атомному номеру. Вот он нам и нужен. Это самое крупное число в ячейке, его нетрудно обнаружить, так как элементы следуют друг за другом практически по порядку (по возрастанию).
- Запоминаем атомный номер.
- Находим массу атома. Это значение также располагается в ячейке элемента периодической системы, чье количество нейтронов мы ищем. Как правило, масса записана более мелким шрифтом, чем номер атома, в виде десятичной дроби. У более сложных элементов заключена в квадратные скобки.
- Для расчетов атомную массу округляем до целого числа.
- Так как ядро атома состоит из нейтронов и протонов, то путем вычитания из массы атома протонов (атомного номера), мы получим величину содержания нейтронов в атоме данного элемента.
Как найти нейтроны — пример
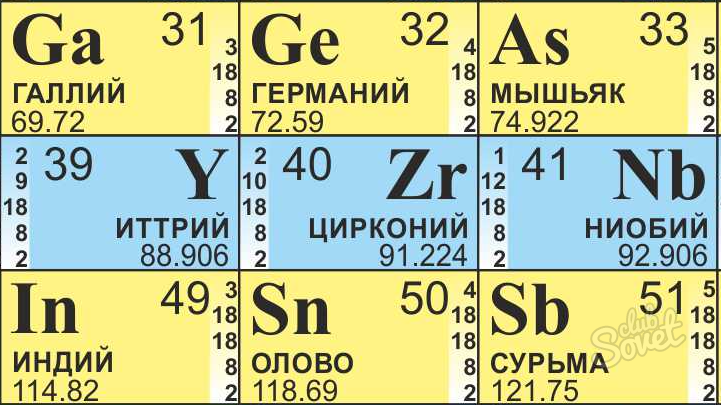
- Например, нам нужно найти, сколько нейтронов находится в атоме Циркония.
- Будем использовать формулу: N = M — n, где:
М — атомная масса, n — атомный номер (число протонов), N — число нейтронов.
- Находим Цирконий в таблице Менделеева, для химических расчетов она всегда должна быть под рукой.
- Его атомная масса равна 91,22, округляем до 91.
- Атомный номер равен 40.
- Получаем, что в атоме Циркония находится 51 (N = 91 — 40) нейтрон.
Как найти нейтроны — находим сколько нейтронов у изотопов
- Изотопы — это разновидности одного и того же элемента, но имеющие различную массу атомов. Но атомный номер, который мы научились искать выше, у них совпадает.
- Нужно знать, что все изотопы определенного элемента помещаются в одну ячейку в таблице Менделеева.
- Раз атомный номер у изотопов одного и того же элемента совпадает, значит нам нужно лишь найти атомную массу для расчета величины нейтронов.
- Атомную массу изотопа найти очень просто — она заключена в самом названии изотопа. Например, О-16, О-17, О-18 — изотопы кислорода с атомной массой 16, 17 и 18 соответственно. Иногда атомную массу записывают как верхний индекс слева от символа хим. элемента.
- Таким образом, нам известны все составляющие для формулы. Нам не составит труда вычислить, какое количество нейтронов находится в изотопе.
Как найти нейтроны — пример, изотоп О-17
- Атомный номер всех изотопов кислорода, как и самого элемента равен 8.
- Атомная масса указана в названии изотопа — она равна 17.
- Вычисляем по формуле N = M — n, что количество нейтронов в атоме изотопа О-17 равно 9 (17 — 8).

Атомное ядро состоит из частиц с общим названием нуклоны. Известно два их вида – нейтроны и протоны. Количество нейтронов можно найти по массе атома, поскольку она практически равна массе атомного ядра (масса электронной оболочки пренебрежимо мала) и его заряду.
Вам понадобится
- - периодическая таблица химических элементов (таблица Менделеева);
- - заряд протона;
- - химические элементы.
Инструкция
Каждый атом вещества описывается в периодической системе химических элементов. Найдите ячейку элемента, соответствующую исследуемому атому. В нижней части ячейки найдите его относительную атомную массу. Если она представлена дробным числом, округлите его до целого (это будет относительная атомная масса самого распространенного в природе изотопа). Это число отражает количество нуклонов в атомном ядре. Найдите порядковый номер исследуемого химического элемента. Он равен числу протонов в ядре. Определите количество нейтронов , отняв от относительной атомной массы количество протонов. Пример. Найдите количество протонов в атоме железа. Атому железа соответствует химический элемент Fe (феррум). Его относительная атомная масса равна 56. Порядковый номер элемента равен 26. Количество нейтронов N=56-26=30.
Для определенного изотопа всегда дается дополнительное пояснение. Перед обозначением элемента указывается его относительная атомная масса и порядковый номер в периодической таблице. В этом случае берите атомную массу, указанную в записи изотопа. Например, обычный кислород имеет массовое число 16 и порядковый номер 8, количество нейтронов в нем N=16-8=8. Его стабильный изотоп кислород-18, имеет соответствующее массовое число и количество нейтронов в ядре N=18-8=10.
Определите количество нейтронов по массе ядра и его заряду. Если масса дана в килограммах, поделите ее на число 1,661 10^(-27). В результате получите массу в атомных единицах массы (относительную атомную массу). Заряд ядра в кулонах поделите на число 1,6022 10^(-19) (заряд одного протона в кулонах). Это будет число протонов. При переводе все величины округляйте до целых. Найдите число нейтронов , отняв от относительной атомной массы количество протонов. Пример. Масса атома равна 11,627 10^(-27) кг. Заряд его ядра составляет 4,8 10^(-19) Кл. Найдите относительную атомную массу элемента 11,627 10^(-27)/(1,661 10^(-27))=7. Рассчитайте количество протонов 4,8 10^(-19) Кл/(1,6022 10^(-19))?3. Определите число нейтронов N=7-3=4.
Атом химического элемента состоит из атомного ядра и электронов. В состав атомного ядра входят два типа частиц - протоны и нейтроны. Почти вся масса атома сосредоточена в ядре, так как протоны и нейтроны намного тяжелее электронов.

Вам понадобится
- атомный номер элемента, изотопы
Инструкция
В отличие от протонов, нейтроны не имеют электрического заряда, то есть их электрический заряд равен нулю. Поэтому, зная атомный номер элемента, нельзя однозначно сказать, сколько нейтронов содержится в его ядре. К примеру в ядре атома углерода всегда содержится 6 протонов, однако протонов в нем может быть 6 и 7. Разновидности ядер химического элемента с разным количеством нейтронов в ядре называются изотопами этого элемента. Изотопы могут быть как природными, так и полученными искусственно.
Атомные ядра обозначаются буквенным символом химического элемента из таблицы Менделеева. Справа от символа вверху и внизу стоят два числа. Верхнее число A - это массовое число атома, A = Z+N, где Z - заряд ядра (число протонов),а N - число нейтронов . Нижнее число - это Z - заряд ядра. Такая запись дает информацию о количестве нейтронов в ядре. Очевидно, оно равно N = A-Z.
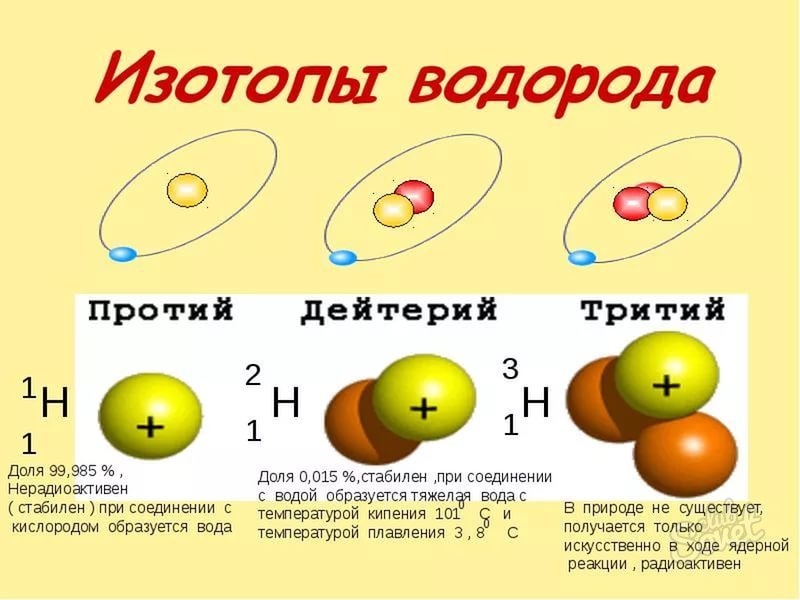
У разных изотопов одного химического элемента число A меняется, что отражено в записи этого изотопа. Определенные изотопы имеют свои оригинальные названия. Например, обычное ядро водорода не имеет нейтронов и имеет один протон. Изотоп водорода дейтерий имеет один нейтрон (A = 2), а изотоп тритий - два нейтрона (A = 3).
Зависимость числа нейтронов от числа протонов отражена на N-Z диаграмме атомных ядер. Устойчивость ядер зависит от отношения числа нейтронов и числа протонов. Ядра легких нуклидов наиболее устойчивы при N/Z = 1, то есть при равенстве количества нейтронов и протонов. С ростом массового числа область устойчивости сдвигается к величинам N/Z>1, достигая величины N/Z ~ 1,5 для наиболее тяжелых ядер.



















